< Curent continuu
11 Baterii
11.1 Activitatea electronilor în reacţiile chimice
Până în acest moment nu am discutat în detaliu modul de funcţionare al bateriilor, ci am presupus pur şi simplu că acestea produc o tensiune constantă la bornele lor printr-un proces „misterios”. În cele ce urmează vom explora procesul în mare urmând să facem nişte precizări cu privire la utilizarea reală a bateriilor în sistemele electrice.
Am discutat în primul capitol despre conceptul de atom. Atomii sunt compuşi din părţi mai mici denumite particule. Particulele elementare dintr-un atom sunt electronii, protonii şi neutronii. Fiecare dintre aceste particule joacă rolul ei în comportamentul atomului. Activitatea electrică implică mişcarea electronilor, iar identitatea chimică (ce determină în mare tipul de material: coductiv/izolator) este determinată de numărul protonilor din nucleu.
Dislocarea protonilor din nucleul atomului este foarte greu de realizat, de aici şi stabilitatea identităţii chimice a atomilor în general. Îndepărtarea electronilor, în schimb, este mult mai uşor de realizat. După cum am văzut, frecarea este unul dintre procedeele prin care electronii pot fi „mutaţi” de pe un material pe altul, la fel este şi căldura, procedeu evidenţiat în cazul termocuplei.
Electronii pot servi însă şi unui alt scop: legarea atomilor între ei. Această legare a atomilor prin intermediul electronilor poartă numele de legătură chimică. O reprezentare simplificată a unei asemenea legături dintre doi atomi arată asfel:
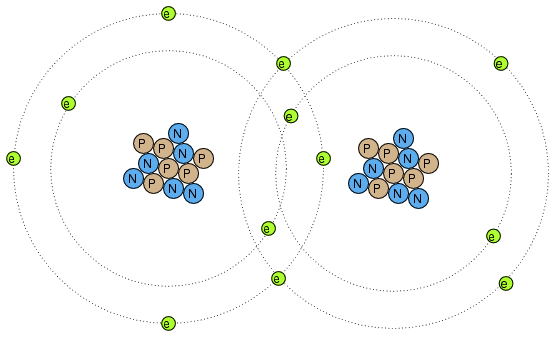
Există mai multe tipuri de legături chimice, cea de sus fiind una covalentă, caracterizată prin împărţirea electronilor de către atomi. Deoarece aceste legături sunt bazate pe legături formate de electroni, ele nu pot fi mai puternice decât gradul de imobilitate al electronilor constituenţi. Ceea ce vrem să spunem este că aceste legături chimice pot fi create sau desfăcute de aceleaşi forţe ce induc deplasarea electronilor: căldura, lumina, frecarea, etc.
Atunci când atomii sunt legaţi între ei prin legături chimice, aceştia formează materiale cu proprietăţi unice numite molecule. Desenul de mai sus, cu doi atomi de acelaşi tip legaţi, este un exemplu de moleculă simplă. Majoritatea moleculelor sunt formate însă din tipuri diferite de atomi. Chiar şi moleculele formate din atomi de acelaşi tip pot prezenta proprietăţi fizice radical diferite.
Însă, pentru studierea bateriilor, trebuie să introducem un alt tip de legătură chimică, cea ionică. Aceasta diferă faţă de legătura covalentă prin faptul că un atom al moleculei posedă un exces de electroni iar celălalt atom are electroni în minus; în acest caz, legătura dintre atomi este rezultatul atracţiei electrostatice dintre cele două sarcini diferite („+” şi „-”). Atunci când legăturile ionice iau naştere din atomi neutrii, există de fapt un transfer de electroni dintre atomii pozitivi şi negativi din punct de vedere electric. Este bine de ştiut faptul că moleculele conţine de obicei ambele tipuri de legături chimice. Hidroxidul de sodiu (NaOH) este format dintr-o legătură ionică dintre atomul de sodiu (pozitiv) şi ionul hidroxil (negativ). Ionul hidroxil formează o legătură covalentă (simbolizată prin bară) între hidrogen şi atomii de oxigen:
Na+ O—H-
Sodiul pierde doar un electroc, sarcina lui fiind +1 în exemplul de mai sus. Dacă un atom pierde mai mult de un electron, sarcina rezultată poate fi desemnată prin +2, +3, +4, etc. sau printr-o cifră romană în paranteze ce desemnează starea sa de oxidare (pierderea electronilor), asfel: (I), (II), (IV), etc. Unii atomi pot avea mai multe stări de oxidare, şi este bine să precizăm starea de oxidare în formula moleculară pentru evitarea confuziilor.
Formarea ionilor şi a legăturilor ionice din atomi neutrii sau molecule (sau invers) presupune transferul de electroni. Acest transfer poate fi folosit pentru generarea curentului electric. Un dispozitiv construit special în acest scop poartă denumirea de pilă voltaică sau, pe scurt, pilă; aceasta este de obicei formată din doi electrozi metalic introduşi într-o substanţă chimică denumită electrolit special concepută pentru facilitarea unei asfel de reacţii electrochimice (oxidare/reducere):
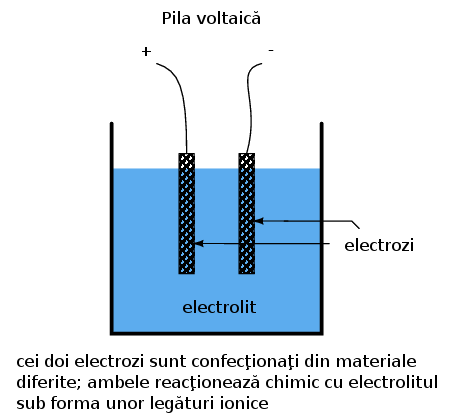
Pila folosită pentru automobile este de obicei cea de „plumb-acid”. Electrodul negativ este confecţionat din plumb (Pb), iar cel pozitiv din dioxid de plumb (IV) (PbO2), ambele substanţe fiind metalice. Soluţia de electrolit este o soluţie diluată de acid sulfuric (H2SO4 + H2O). Dacă electrozii pilei sunt conectaţi la un circuit extern, asfel încât să fie posibilă deplasarea electronilor de la un electrod la celălalt, atomii de plumb (IV) din electrodul pozitiv (PbO2 vor câştiga fiecare câte doi electroni pentru a produe Pb(II)O. Atomii de oxigen rezultaţi se vor combina cu ionii pozitivi de hidrogen (H)+ şi formează apă (H2O). Această deplasare a electrolinor spre electrodul PbO2 îi conferă o sarcină pozitivă. Atomii de plumb din electrodul negativ cedează fiecare câte doi electroni pentru a produce plumb Pb(II), care în conbinaţie cu ionii de sulfat (SO4-2), produşi prin disociaţia ionilor de hidrogen (H+) din acidul sulfuric (H2SO4), formează sulfatul de plumb (PbSO4. Deplasarea electronilor dinspre electrodul de plumb îi conferă sarcina electrică negativă. Aceste reacţii sunt reprezentate mai jos:
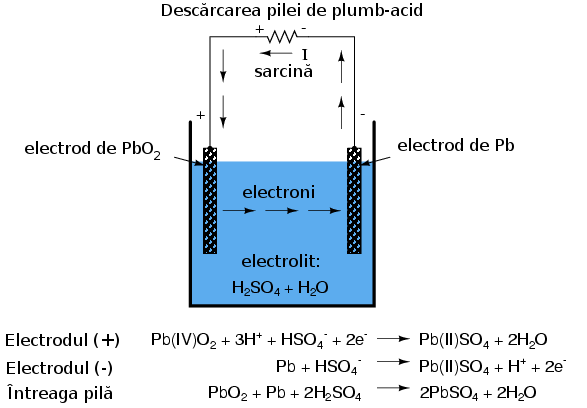
Acest proces prin care pila produce energie pentru alimentarea sarcinii se numeşte descărcare şi provine de la faptul ca aceasta îşi epuizează rezervele chimice interne în urma acestui proces. Teoretic, după ce întreaga cantitate de acid sulfuric se consumă, din pilămai rămân cei doi electrozi de sulfat de plumb (PbSO4) şi o soluţie electrolitică de apă pură (H2O); această situaţie nu mai permite formarea legăturilor ionice adiţionale. În acest moment, pila se spune că este complet descărcată. Stadiul de încărcare poate fi determinat în acest caz de concentraţia soluţiei acide.
Nu toate pilele voltaice sunt construite pe baza aceloraşi reacţii chimice, dar lucrul cel mai important de reţinut este că electronii sunt „motivaţi” să se deplaseze între cei doi electrozi de către reacţiile ionice dintre moleculele electrozilor şi moleculele electrolitului. Reacţia este activată atunci când există un drum exterior închis (complet) pentru formarea curentului electric. La întreruperea acestui circuit, reacţiile chimice încetează.
Valoarea tensiunii generate de o celulă depinde de tipul reacţiilor chimice ce au loc în interiorul acesteia, mai bine spus, de configuraţia chimică a celulei. În exemplul de mai sus, pila de plumb-acid prezintă la bornele sale o tensiune nominală de 2.04 V, atunci când este încârcată la maxim (cocentraţia de acid ridicată). Pila Edison, confencţionată din oxid de nickel (electrodul pozitiv) şi fier (electrodul negativ), cu o soluţie electrolitică de hidroxid de potasiu generează o tensiune nominală de 1.2 V.
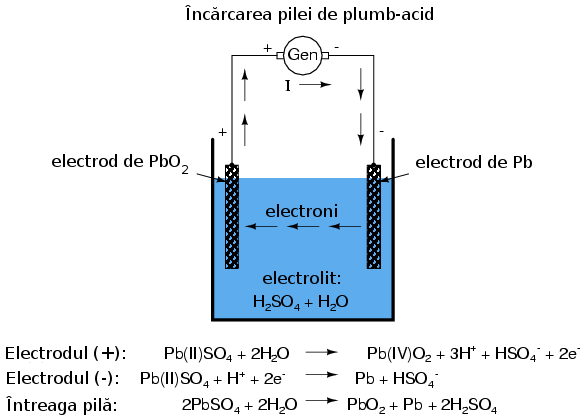
Încărcarea pilei voltaice
În cazul anumitor tipuri de pile, reacţiile chimice pot fi inversate forţând curgerea curentului în sens invers prin pilă. Acest proces poartă denumirea de încărcare. O asfel de pila reîncărcabilă se numeşte pilă secundară. O pilă a cărei compoziţii chimice nu poate fi readusă la starea iniţială se numeşte pilă primară.
Încărcarea unei pile de plumb-acid printr-o sursă de curent externă duce la inversarea reacţiilor chimice din interiorul acesteia:
11.2 Construcţia bateriilor electrice
Cuvântul baterie înseamnă pur şi simplu un grup de componente similare aduse împreună. O baterie electrică este un set de pile voltaice realizate cu scopul generării unei valori a tensiunii şi curentului mai mari decât este posibil cu doar o singură pilă.
Simbolul unei pile constă din două linii paralele, una mai scurtă şi una mai lungă, conectate la capete cu câte un fir:
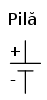
În aceeiaşi ordine de idei, simbolul bateriei constă din mai multe pile conectate în serie:
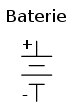
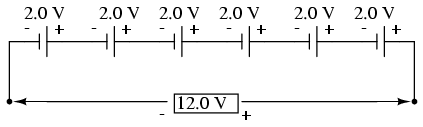
După cum am mai spus, tensiunea produsă de un anumita tip de pilă depinde doar de compoziţia ei chimică, mărimea pilei este irelevantă în acest caz. Pentru obţinerea unei tensiuni mai mari prin urmare, trebuie să conectăm mai multe pile în serie. Tensiunea totală la bornele unei baterii este suma tuturor tensiunilor pilelor. O baterie tipică plumb-acid instalată pe un automobil generează o tensiune nominală de 12.0 V (6 x 2.0 V):
Ca şi convenţie, simbolul bateriei este desenat de obicei cu doar patru linii lungi/scurte, chiar dacă bateria reală este compusă din mai mult de patru pile. Totuşi, se poate ca în unele cazuri să întâlnim un simbol al bateriei cu foarte multe linii lungi/scurte; folosim acest simbol pentru reprezentarea unei baterii cu o tensiune neobişnuit de mare:

Deşi mărimea fizică a unei pile nu are nicio relevanţă cu privire la valoarea tensiunii generate, are totuşi importanţă atunci când luăm în considerarea rezistenţa acesteia şi prin urmare determină cantitatea maximă de curent ce o poate genera în circuit. Orice celulă voltaică posedă o anumită rezistenţa internă datorată electrozilor şi soluţiei electrolitice. Cu cât pila este mai mare, cu atât este mai mare suprafaţa de contact a electrozilor cu electrolitul, ceea ce se traduce printr-o rezistenţă internă mai scăzută.
Deşi în mod normal considerăm că bateria se comportă ca o sursă perfectă de tensiune (absolut constantă) într-un circuit, considerând curentul ce-o străbate ca depinzând strict de rezistenţa externă a circuitului de care este ataşată, acest lucru nu se întâmplă de fapt în realitate. Deoarece fiecare baterie sau pilă posedă o anumită rezistenţa internă, aceasta afectează valoarea curentului în oricare circuit:
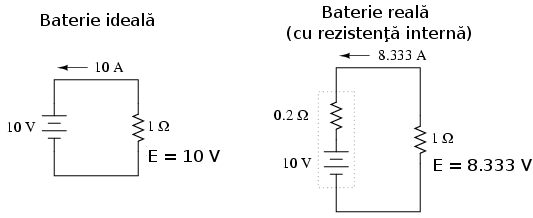
Bateria reală de mai sus posedă o rezistenţă internă de 0.2 Ω; acest lucru afectează performanţa bateriei atunci când alimentează sarcina de 1 Ω. Bateria ideală din stânga nu are rezistenţă internă, şi din această cauză, aplicarea legii lui Ohm (I=E/R) rezultă într-o valoare a curentului de 10 A pentru o rezistenţă de 1 Ω şi 10 V tensiune de alimentare. Dar, bateria reală are o rezistenţă în plus ce se opune şi ea deplasării electronilor, curentul generat în circuit în acest caz este de numai 8.333 A pentru aceeiaşi valoare a sarcinii.
Bateria ideală în scurt circuit (rezistenţă de 0 Ω a sarcinii) generează un curent infinit. Pe de altă parte, bateria reală, poate genera doar 50 A (10 V/ 0.2 Ω) într-un scurt circuit de 0 Ω datorită rezistenţei interne. Ca să nu existe nicio confuzie, reacţiile chimice interne produc o tensiune tot de 10 volţi şi în cazul bateriei reale, dar o parte din aceasta cade pe rezistenţa internă a bateriei şi prin urmare căderea te tensiune pe sarcina circuitului nu este 100% din valoarea totală a tensiunii generate de baterie.
În mod normal bateriile sunt folosite în circuite în care rezistenţele lor interne sunt neglijabile în comparaţie cu rezistenţele sarcinilor (curentul de scurt circuit este mult mai mare decât curentul normal prin sarcină), comportamentul lor în acest caz este foarte apropiat de cel al bateriilor reale.
Dacă totuşi avem nevoie de o baterie cu rezistenţă internă mult mai mică (pentru curenţi mai mari) decât cea a unei singure pile, putem conecta mai multe pile în paralel:
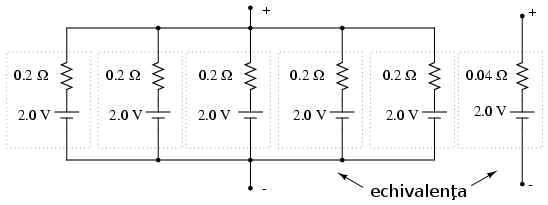
Circuitul Thevenin echivalent al celor cinci pile în paralel este un circuit cu o singură sursă de tensiune şi un rezistor în serie. Acest circuit are aceeiaşi valoare a tensiunii (2.0 V) dar o rezistenţa mai mică (0.04Ω) decât oricare dintre rezistenţele individuale ale pilelor (0.2 Ω).
11.3 Capacitatea bateriilor
Datorită faptului că bateriile dau naştere unei curgeri de electroni prin circuit prin intermediul reacţiilor chimice (schimb de electroni), şi, datorită faptului că numărul de molecule dintr-o baterie este limitat, trebuie să existe o limită a cantităţii totale de electroni dintr-o baterie ce sunt „împinşi” în circuit, înainte ca rezervele de energie a acesteia să se termine. Am putea măsura capacitatea unei baterii referindu-ne la numărul total de electroni, dar această cifră ar fi extrem de mare. Am putea folosi coulomb-ul (egal cu 6,25 x 1018 electroni), astfel încât cantităţile cu care lucrăm să fie mult mai practice.
11.3.1 Amper-oră Ah
Totuşi, în practică, nu se utilizează mărimile de mai sus, ci se lucrează cu amper-oră (Ah). Din moment ce un amper reprezintă o curgere de un coulomb de electroni pe secundă, iar într-o oră sunt 3.600 de secunde, putem exprima o relaţie directă între numărul de coulombi (numărul de electroni) şi amper-oră: 1 Ah - 3600 C.
O baterie cu o capacitate de 1 Ah poate alimenta o sarcină cu un curent continuu de 1 A pentru o perioadă de 1 oră, sau 2 A pentru o jumătate de oră, etc. După această perioadă, spunem că baterie este descărcată. În cazul unei baterii ideale, relaţia dintre curentul continuu şi timpul de descărcare este stabilă şi absolută. Bateriile reale nu au însă acest comportament. Din acest motiv, atunci când se dă numărul de amperi-oră pentru o baterie, acest număr este specificat fie pentru o anumită valoare a curentului, fie a timpului, fie se presupune că este dată pentru o perioadă de 8 ore (în cazul în care nu este inclus alt factor de limitare).
În cazul acumulatorilor, notaţia amper-oră specifică de fapt timpul necesar de încărcare pentru o anumită valoare a curentului de încărcare. De exemplu, o baterie auto de 70 amperi-oră, complet descărcată, va necesita o perioadă de încărcare de 10 ore la un curent de încărcare constant de 7 A (70 / 7).
11.3.2 Descărcarea bateriilor
De exemplu, o baterie auto tipică poate avea o capacitate de 70 Ah, specificată pentru un curent de 3,5 A. Acest lucru înseamnă că bateria ar putea genera un curent de 3,5 A pentru o perioadă de 20 de ore (70 / 3,5). Dar, să presupunem că am conecta o sarcină cu o rezistenţă mai mică la bornele bateriei, sarcină ce consumă un curent de 70 A. Ecuaţia noastră ne-ar spune că în acest caz, bateria ar funcţiona pentru exact o oră (70 / 70), dar acest lucru nu este neapărat valabil în realitate. În cazul unor curenţi mai mare, bateria va disipa o căldură mai mare pe rezistenţa sa internă. Efectul constă în modificarea reacţiilor chimice ce au loc în interiorul acesteia. Realitatea este că, bateria se va descărca într-o perioadă mai mică de timp decât o oră.
Invers, dacă ar fi să conectăm o sarcină uşoară (1 mA) la bornele bateriei, ecuaţia ne-ar spune că baterie ar trebui să genereze putere pentru o perioadă de 70.000 de ore, puţin sub 8 ani. Totuşi, sunt foarte mari şanse ca energia chmică a unei baterii reale să se consume datorită altor factori, precum evaporarea electrolitului, deteriorarea electrozilor, scurgeri de curent în interiorul bateriei, înainte de perioada de 8 ani calculată mai sus.
În concluzie, relaţia amper-oră este doar o aproximare ideală a unei baterii reale. Această trebuie luată în considerare doar pentru valori apropiate de curent sau de timp specificate de producător. Unii producători specifică însă factori de reducere a capacităţii totale pentru funcţionarea la curenţi şi/sau temperaturi diferite de cele standard.
11.3.3 Verificarea stării de încărcare a unei baterii
Pe măsură ce o baterie se descarcă, pe lângă diminuarea stocului de energie internă, creşte şi rezistenţa internă a acesteia. Electrolitul devine din ce în ce mai puţin conductiv iar tensiunea bateriei scade pe măsură ce substanţele chimice devin din ce în ce mai diluate. Cel mai înşelător efect al unei baterii care se descarcă este creşterea rezistenţei. Cea mai bună metodă de verificare a stării unei baterii constă în măsurarea căderii de tensiune la bornele sale când aceasta se află conectată în circuit şi generează un curent electric considerabil. Altfel, o simplă conectare a voltmetrului la bornele bateriei poate indica eronat o baterie „sănătoasă” (tensiune corespunzătoare), chiar dacă rezistenţa sa internă a crescut considerabil. Curentul electric „considerabil” este determinat de parametrii de proiectare a fiecărei baterii în parte. O cădere de tensiune prea mică (indicată de voltmetru), va indica, evident, o baterie descărcată. Să luăm câteva exemple.
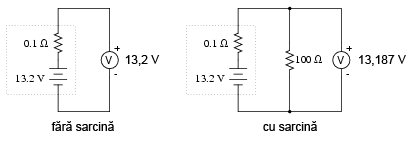
Scenariul pentru o baterie complet încărcată arată aproximativ astfel:
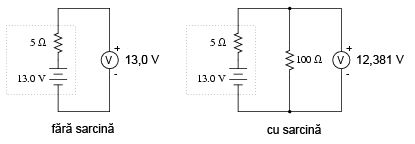
Dacă bateria se descarcă puţin:
Apoi puţin mai mult:
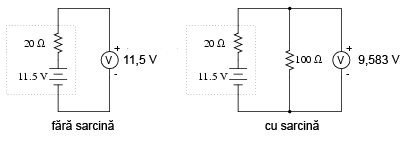
Şi încă puţin până când este complet descărcată:
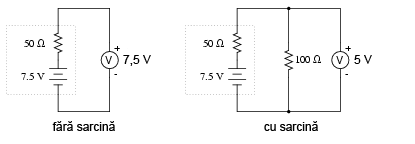
Observaţi diferenţa dintre valoarea tensiunii măsurată cu ajutorul voltmetrului în funcţie de conectarea sau neconectarea bateriei la o sarcină. Înseamnă oare acest lucru că este inutil să verificăm o baterie doar cu ajutorului unui voltmetru (fără sarcină)? Nu chiar. Dacă un voltmetru simplu indică o valoare de doar 7,5 V pentru o baterie de 13,2 V, putem deduce fără urmă de îndoială că aceasta este descărcată. Totuşi, dacă voltmetrul ar indica 12,5 V, bateria este aproape încărcată. Atenţie însă, mărimea rezistorul folosit pe post de sarcină trebuie să corespundă puterii maxime disipate de baterie. Pentru verificarea bateriilor mari, precum bateriile auto (12 V) de plumb-acid, acest lucru înseamnă că va trebui să folosim un rezistor ce poate suporta o putere de câteva sute de W (watt).
11.4 Baterii speciale
11.4.1 Pila standard cu mercur
Pe vremuri, un tip special de baterie, cunoscuta sub numele de pilă standard cu mercur, era folosită ca şi etalon (standard) pentru calibrarea tensiunilor. Ieşirea unei pile cu mercur era între 1,0184 şi 1,0194 V c.c. (în funcţie de tipul pilei), fiind extrem de stabilă în timp. Variaţia tensiunii era în jurul valorii de 0,004% pe an. Alternativ, pilele cu mercur erau cunoscute si sub numele de pile cu cadmium sau pile Weston. Structura unei astfel de pile este prezentată în figura de mai jos:
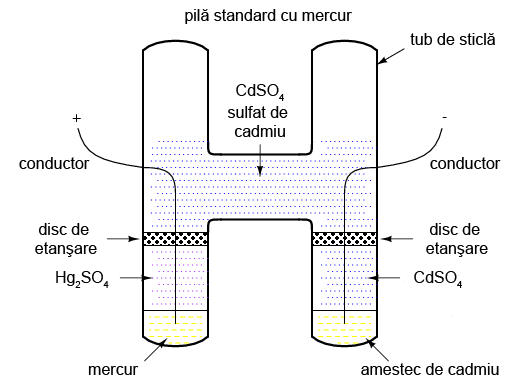
Din păcate, pilele cu mercur sunt intolerante la „scurgerile” de curent şi nu pot fi măsurate cu un voltmetru analogic fără a compromite acurateţea măsurătorii. Producătorii menţionau un curent nu mai mare de 0,1 mA prin pilă, dar chiar şi această cifră era considerată de moment, sau instantanee maximă. Prin urmare, pilele standard nu puteau fi măsurate decât cu un dispozitiv potenţiometric (detector de nul), pentru care curentul de funcţionare este zero. Scurt-circuitarea unei pile cu mercur este stric interzisă. După scurt-circuitare, pila nu mai putea fi folosită ca şi dispozitiv standard. Pilele cu mercur sunt de asemenea susceptibile la variaţii mici de tensiune în cazul „bruscării” lor fizice sau termice.
Există două tipuri de pile standard cu mercur, în funcţie de nevoile de calibrare: saturate şi nesaturate. Pilele standard saturate oferă cea mai bună stabilitate a tensiunii în timp, suferind în schimb de o instabilitate termică. Cu alte cuvinte, variaţia tensiunii este neglijabilă în timp (o variaţie de doar câţiva microvolţi în decurs de 10 ani!), dar este mare schimbările de temperatură (zeci de microvolţi per grad Celsius). Aceste pile funcţionează cel mai bine în medii de laborator controlate din punct de vedere termic, şi unde stabilitatea tensiunii este de o importanţa crucială.
Pilele nesaturate oferă o foarte bună stabilitate termică în dauna stabilităţii în timp. Tensiunea rămâne practic constantă odată cu variaţia temperaturii, dar scade constant cu aproximativ 100 µV pe an. Acest celule erau utilizate cel mai adesea ca şi dispozitive de calibrare „de teren”. Temperatura ambiantă nu poate fi controlată precis în aceste situaţii. Tensiunea nominală a unei pile saturate este de 1,0186 V, iar a cele nesaturate de 1,019 V.
Dispozitivele de calibrare semiconductoare moderne au înlocuit în totalitate pilele standard ca şi referinţe de laborator sau „de teren” pentru tensiuni.
11.4.2 Pila de combustie
Un dispozitiv fascinant, foarte asemănător pilei voltaice, este pila de combustie. Acest dispozitiv utilizează reacţia chimică de combustie (ardere) pentru generarea unui curent electric. Procesul de oxidare chimică (formarea legăturilor ionice ale oxigenului cu alte elemente) poate produce o deplasare de electroni între doi electrozi asemănător unei combinaţii de metale şi electroliţi. O pilă de combustie este practic o baterie alimentată de la o sursă externă de energie chimică:
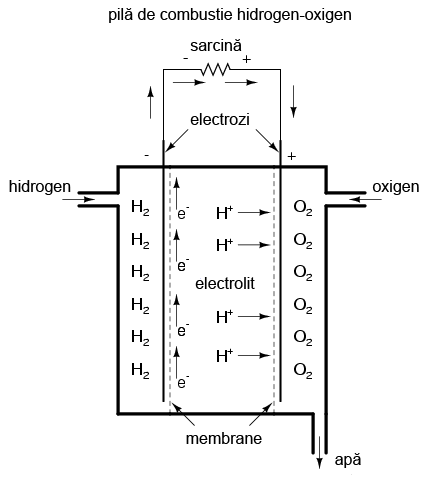
Pe măsură ce „arde” hidrogen, singurele emisii ale unei pile de combustie sunt apă şi o cantitate mică de căldură. Eficienţa transformării energiei chimice în energie electrică, în cazul unei pile de combustie, este mult mai mare decât limita de eficientă Carnot pentru orice motor cu ardere (combustie) internă.
11.4.3 Celula solară
Un alt tip de „baterie” este celula (pila) solară, un produs al electronicii (semiconductor). Efectul fotoelectric, conform căruia electronii sunt „smulşi” din atomi sub influenţa luminii, este pus în aplicare pentru generarea de curent electric prin intermediul luminii. Eficienţa celulelor solare este destul de mică, dar beneficiile utilizării acesteia ca şi sursă de energie sunt nenumărate: nu există părţi mobile, zgomot, poluare sau emisii şi o viaţa practic infinită:
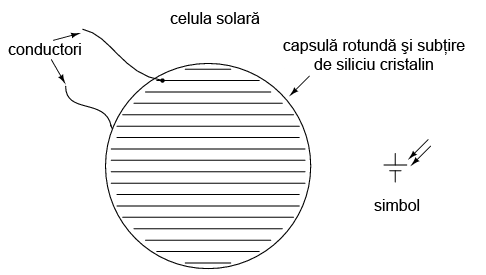
11.4.4 Pila chimică de detecţie
Un alt tip de „baterie” specială este pila chimică de detecţie. Pe scurt, aceste pile reacţionează chimic cu o substanţa specifică din mediul lor ambiant (din aer) pentru a crea o cădere de tensiune proporţională cu concentratia substanţei respective. O aplicaţie practică a unei pile chimice de detecţie constă în detecţia şi măsurarea concentraţiei de oxigen. Majoritatea analizoarelor de oxigen sunt construite în jurul acestor mici pile. Pila chimică trebuie astfel proiectată încât să corespundă substenţei(lor) ce se doresc a fi detectate. Aceste pile tind să se uzeze, pe măsură de materialele chimice se epuizează sau se contaminează în decursul utilizării.
11.5 Consideraţii practice
La conectarea bateriilor în serie (sau paralel), trebuie să fim atenţi la caracteristicile fiecărei baterii, pentru a nu cauza probleme.
11.5.1 Conectarea în serie a bateriilor
Să luăm pentru început cazul conectării bateriilor în serie pentru obţinerea unei tensiuni mai mari:
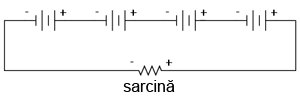
Cunoaştem faptul că valoarea curentului într-un circuit serie este aceiaşi în toate punctele. Oricare ar fi valoarea curentului în circuit, aceasta trebuie să fie aceiaşi prin fiecare baterie. Din acest motiv, toate bateriile trebuie să fie egale din punct de vedere al valorii amper-oră. În caz contrar, unele din baterii se vor goli mai repede decât celelalte, iar capacitatea întregului circuit va fi compromisă. Capacitatea amper-oră totală a acestui circuit serie nu este afectate de numărul de baterii conectate.
11.5.2 Conectarea în paralel a bateriilor
Să luăm cazul conectării bateriilor în paralel pentru creşterea curentului în circuit (rezistenţă înternă mai mică), sau creşterea capacităţii amper-oră:
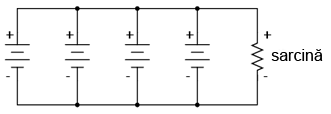
Cunoaştem faptul că într-un circuit paralel, căderea de tensiune este egală pe toate ramurile. Trebuie să ne asigurăm aşadar că tensiunea acestor baterii este egală. În caz contrar, vor exista curenţi relativ mari de la o baterie spre alta, bateriile cu o tensiune mai mare dominând bateriile cu tensiune mai mică. Acest lucru nu este de dorit.
11.5.3 Protejarea circuitelor cu siguranţe fuzibile
În aceiaşi ordine de idei, trebuie să ne asigurăm că orice elemente de protecţie la supracurent (siguranţe fuzibile sau întrerupătoare automate) sunt instalate astfel încât să fie eficiente. Pentru circuitul serie de mai sus, o singură siguranţă fuzibilă este suficientă pentru protecţia la supracurent a conductorilor, din moment ce orice deschidere a circuitului va opri curentul în întreg circuitul:
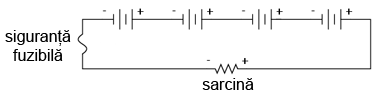
În cazul unor baterii conectate în paralel însă, o singură siguranţa fuzibilă este suficientă pentru protejarea conductorilor la supracurent (conectată între sarcină şi bateriile conectate în paralel). În acest caz însă, avem şi alte situaţii pe care trebuie să le luăm în considerare. Se ştie faptul că, în cazul bateriilor, pot apărea scurt-circuite interne datorită „defectării” mediului de separare dintre electrozi. Bateriile bune vor domina bateriile defecte (tensiune mică), ducând la apariţia unor curenţi relativ mari pe aceste ramuri. Pentru a ne proteja de un astfel de eveniment, fiecare baterie trebuie protejată la supracurent printr-o singuranţă fuzibilă individuală, pe lângă siguranţa fuzibilă principală:
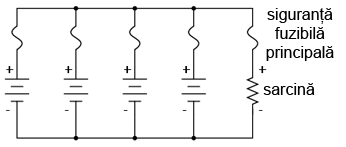
11.5.4 Alte observaţii legate de baterii şi acumulatori
Atunci când avem de a face cu acumulatori, trebuie să fim atenţi la modul lor de încărcare. În fucţie de tipul şi modul de construcţie, acumulatorii au nevoi diferite când vine vorba de încărcarea lor. De obicei, producătorii oferă unele recomandări cu privire la modul de proiectare şi de menţinere a unui sistem electric ce utilizează acumulatori.
Există două probleme principale: iterarea şi supraîncărcarea. Iterarea se referă la procesul de încărcare şi descărcare a unei baterii. Toate bateriile au un anumit număr de iteraţii permise. Supraîncărcarea reprezintă condiţia în care curentul continuă să fie forţat în sens invers prin acumulator, dincolo de punctul în care acesta a a tins încărcarea maximă. În cazul bateriilor de plumb-acid în special, supraîncărcarea duce la electroliza apei („fierberea” apei în afara bateriei) şi la scurtarea vieţii bateriei.
Toate bateriile care conţin apă în electrolit produc hidrogen datorită electrolizei. Acest lucru este în special valabil în cazul bateriilor de plumb-acid, dar nu numai. Hidrogenul este un gaz extrem de inflamabil, în special în prezenţa oxigenului liber creat de acelaşi proces de electroliză, inodor şi incolor. Asemenea baterii reprezintă un real pericol de explozie chiar şi în condiţii normale de funcţionare, şi trebuie tratate cu mare grijă. Autorul a fost martorul exploziei unei baterii de plumb-acid. O singură scânteie creată de îndepărtarea unei surse de curent continuu pentru încărcarea unei baterii auto a dus la aprinderea hidrogenului din interiorul carcasei bateriei. Partea superioară a bateriei s-a desprins, împrăştiind acid sulfuric peste tot. Din fericire, personalul purta ochelari şi echipament de protecţie. În caz contrar, s-ar fi putut produce arsuri grave.
La conectarea şi deconectarea echipamentului de încărcare a unei baterii, asiguraţi-vă că ultima conexiune (sau prima întrerupere a circuitului) se realizează la o distanţă suficientă faţă de baterie, astfel încât, orice scânteie rezultată să nu conducă la aprinderea hidrogenului. p>